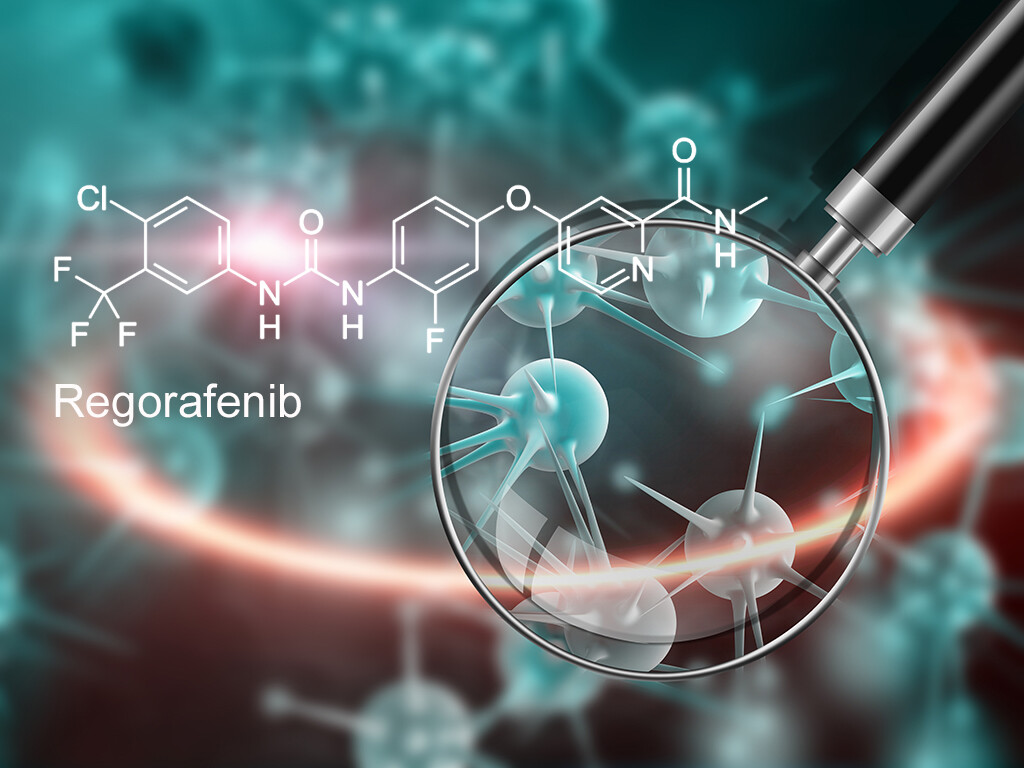
Der Tyrosinkinaseinhibitor Regorafenib (Stivarga) ist zugelassen bei Erwachsenen mit metastasiertem Darmkrebs und bringt Vorteile beim Gesamtüberleben.
Regorafenib (Handelsname Stivarga) ist seit August 2013 für Erwachsene mit metastasiertem Darmkrebs zugelassen, bei denen die bisherigen Behandlungsalternativen nicht mehr wirken oder für die diese Alternativen nicht geeignet sind. Nach einer ersten frühen Nutzenbewertung im Januar 2014 hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) nun erneut überprüft, ob der Wirkstoff gegenüber der zweckmäßigen Vergleichstherapie einen Zusatznutzen bietet. Das IQWiG sieht einen Anhaltspunkt für einen geringen Zusatznutzen von Regorafenib: die Patientinnen und Patienten einen Überlebensvorteil, allerdings treten bestimmte schwere Nebenwirkungen häufiger auf.
Vorteil von Regorafenib beim Gesamtüberleben – bei schweren Nebenwirkungen
Auch wenn man die Daten der CONCUR-Studie einbezieht, haben die Bewertungsergebnisse zu den Endpunkten Gesamtüberleben und Nebenwirkungen Bestand: Beim Gesamtüberleben gibt es einen statistisch signifikanten Unterschied zugunsten von Regorafenib, woraus sich ein beträchtlicher Zusatznutzen ableiten lässt.
Zugleich treten aber schwere Nebenwirkungen unter Regorafenib häufiger auf: Das gilt insbesondere für bestimmte Hautausschläge (Exantheme), das Hand-Fuß-Syndrom sowie für schwere Müdigkeit – Fatigue – sowie Durchfall.
Kurzprofil Regorafenib (Stivarga)
Regorafenib (Stivarga) wird zur Behandlung von Krebserkrankungen eingesetzt, indem es das Wachstum und die Verbreitung von Krebszellen verlangsamt und die für das Wachstum von Krebszellen wichtige Blutversorgung unterbricht.
Regorafenib wird angewendet zur Behandlung erwachsener Patienten mit Dickdarm- oder Enddarmkrebs, der sich in andere Körperteile ausgebreitet hat, wenn sie zuvor deswegen mit anderen Arzneimitteln behandelt wurden oder mit diesen Arzneimitteln (Fluoropyrimidin-basierte Chemotherapie, eine Anti-VEGF-Therapie und eine Anti-EGFR-Therapie) nicht behandelt werden konnten.
Weiters kommt Regorafenib bei Erwachsenen mit gastrointestinalen Stromatumoren (GIST), einer Krebsart im MagenDarm-Trakt, die sich in andere Körperteile ausgebreitet hat oder durch eine Operation nicht entfernt werden kann, wenn sie zuvor mit anderen Krebsmitteln wie Imatinib und Sunitinib behandelt wurden.
Quelle und weitere Informationen:
https://www.iqwig.de/download/A15-43_Regorafenib_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf – Kurzfassung der Nutzenbewertung
http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Product_Information/human/002573/WC500149164.pdf
http://www.bayerhealthcare.at/html/pdf/gi/Stivarga.pdf