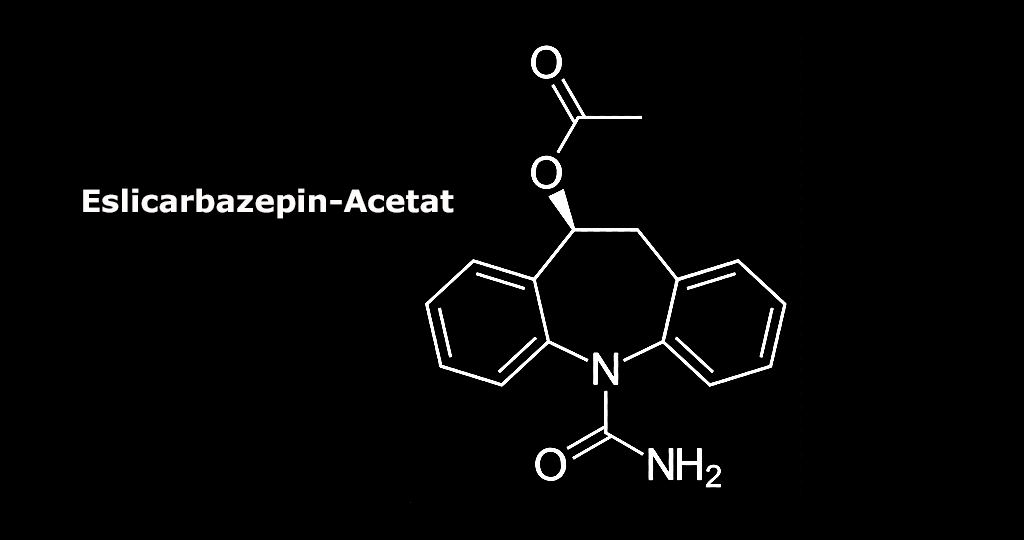
Eslicarbazepinacetat wurde nun als einmal tägliche Monotherapie partieller Anfälle bei Erwachsenen mit neu diagnostizierter Epilepsie zugelassen.
Die Europäische Kommission hat nun Zebinix® – Eslicarbazepinacetat, ESL – als einmal täglich einzunehmende Monotherapie partieller Anfälle bei Erwachsenen mit neu diagnostizierter Epilepsie zugelassen. Zebinix® ist in der EU bereits als Begleittherapie bei Erwachsenen, Jugendlichen und Kindern über 6 Jahren mit partiellen epileptischen Anfällen mit oder ohne sekundäre Generalisierung zugelassen.[1]
Diese Zulassung basiert auf den Ergebnissen einer randomisierten, doppelblinden, aktiv kontrollierten Phase-III-Studie (Studie 311), in der die einmal täglich einzunehmende Monotherapie mit ESL mit zweimal täglich eingenommenem retardierten Carbamazepin (CBZ-CR) bei Erwachsenen mit neu diagnostizierter partieller Epilepsie verglichen wurde. Der primäre Endpunkt der Studie war der Anteil der Patienten, die in der gesamten 26-wöchigen Evaluationsphase anfallsfrei waren.[2] Die Studie konnte zeigen, dass 71,1 %
(n = 276/388) der mit ESL behandelten Patienten und 75,6 % (n = 300/397) der mit CBZ-CR behandelten Patienten während der 26-wöchigen Evaluationsphase anfallsfrei waren. Der Anteil der Patienten, die bei der letzten evaluierten Dosis ein Jahr lang anfallsfrei waren, betrug 64,7 % (n = 251/388) bei den Patienten, die ESL erhielten, und 70,3 % (n = 279/397) bei den Patienten, die mit CBZ-CR behandelt wurden.[2]
Epilepsie eine der weltweit häufigsten neurologischen Erkrankungen
Epilepsie ist eine der weltweit häufigsten neurologischen Erkrankungen, unter der in Europa ca. 6 Millionen Menschen und schätzungsweise 50 Millionen Menschen weltweit leiden.[10] Epilepsie ist eine chronische Erkrankung des Gehirns und betrifft Menschen aller Altersgruppen. Sie ist durch abnorme neuronale Entladungen im Gehirn gekennzeichnet, die krampfartige Anfälle auslösen. Anfälle sind in der Stärke unterschiedlich und reichen von kurzen Aussetzern der Aufmerksamkeit oder Muskelzucken bis hin zu lang anhaltenden, schweren Krampfanfällen. Je nach Anfallsform können diese auf bestimmte Teile des Gehirns beschränkt sein oder als generalisierte Anfälle das ganze Gehirn betreffen. Auch die Häufigkeit der Anfälle kann zwischen weniger als einem Anfall pro Jahr und mehreren Anfällen täglich variieren. Epilepsie hat viele mögliche Ursachen, die genaue Ursache ist jedoch häufig unbekannt.
„Epilepsie ist eine chronische Erkrankung des Gehirns und eine der weltweit häufigsten neurologischen Erkrankungen“, erklärt Eugen Trinka, Professor und Leiter der Neurologie in der Christian-Doppler-Klinik – Universitätsklinikum der Paracelsus Medizinischen Privatuniversität, Salzburg, Österreich. „Mit dieser Zulassung haben mehr als die Hälfte aller Patienten, die unter fokalen epileptischen Anfällen leiden, nun die Chance auf eine neue Monotherapie.“
Eslicarbazepinacetat für erwachsene Patienten mit fokalen epileptischen Anfällen
Eslicarbazepinacetat verfügt über einen innovativen Wirkmechanismus, der sich von dem anderer Natriumkanalblocker unterscheidet.[1],[3] Er zielt selektiv auf den langsam aktivierten Status des Natriumionenkanals ab und reduziert so die Anzahl wiederholter neuronaler Entladungen.[3] Die empfohlene Anfangsdosis beträgt 400 mg einmal täglich. Diese sollte nach ein bis zwei Wochen auf 800 mg einmal täglich erhöht werden. Je nach individuellem Ansprechen kann die Dosis auf bis zu 1.200 mg einmal täglich angehoben werden. Manche Patienten unter Monotherapie können von einer Dosis von 1.600 mg einmal täglich profitieren.[1]
„Wir sind wirklich froh, dass nun ein Präparat zur monotherapeutischen einmal täglichen Anwendung zur Verfügung steht, das erwachsenen Patienten mit fokalen epileptischen Anfällen in ganz Europa helfen kann. Durch die einfache Anwendung wird außerdem die Therapietreue erheblich verbessert“, erläutert António Portela, CEO von Bial, Porto, Portugal. „Bial hat sich zum Ziel gesetzt, Epilepsiepatienten auf der ganzen Welt mit seinem anhaltenden Engagement zu helfen. Wir freuen uns daher auf die weitere Zusammenarbeit mit den entsprechenden Organisationen und Fachgesellschaften für Epilepsie, um allen Patienten diese neue Behandlungsmöglichkeit zur Verfügung stellen zu können.“
„Mit dieser Entscheidung der Europäischen Kommission für die Zulassung von Eslicarbazepinacetat wird das von Eisai erbrachte Engagement für die Forschung und Entwicklung im Bereich neuer neurologischer Therapiemöglichkeiten, die zu einer besseren und wirksameren Behandlung von Epilepsie beitragen können, noch weiter verstärkt. Dieser Schritt stellt einen Meilenstein in der Epilepsietherapie dar. Erwachsenen Patienten in Europa mit neu diagnostizierter Epilepsie steht nun ein noch breiteres Spektrum an Behandlungsmöglichkeiten zur Verfügung“, so Neil West, Vice President EMEA, Global Neurology Business Unit bei Eisai.
Eine Sicherheitsanalyse in der Phase-III-Studie zeigte, dass das Verträglichkeitsprofil von ESL dem von zweimal täglich verabreichtem CBZ-CR ähnlich ist.[4] Unerwünschte Ereignisse (UE) unter ESL waren in den meisten Fällen von milder Intensität und entsprachen dem bereits bekannten Sicherheitsprofil. Die Inzidenzraten UE waren ebenfalls ähnlich, jedoch bei den Patienten, die CBZ-CR erhielten, ein wenig höher (77,7 %) (n = 320/412) als bei Patienten, die mit ESL behandelt wurden (75,3 %) (n = 302/401). Auch die Raten möglicherweise behandlungsbezogener UE waren bei den Patienten, die CBZ-CR erhielten, leicht höher (49,5 %) (n = 204/412) als bei Patienten, die ESL erhielten (41,1 %) (n = 165/401). Ebenso verhielt es sich mit den Raten möglicherweise behandlungsbezogener schwerwiegender UE (2,7 % im Vergleich zu 2,0 %) (n = 11/412 im Vergleich zu n = 8/401) und den Raten von zum Therapieabbruch führender UE (18,0 % im Vergleich zu 13,5 %) (n = 74/412 im Vergleich zu n = 54/401). Die am häufigsten berichteten möglicherweise behandlungsbezogenen UE bei ESL waren (in der Reihenfolge des Auftretens): Schwindel, Kopfschmerzen, Schläfrigkeit, Müdigkeit und Übelkeit.[4]
Die ständige Weiterentwicklung von Eslicarbazepinacetat unterstreicht das von Bial und Eisai erbrachte Engagement im Bereich der Forschung und Entwicklung, um neue wirksame Behandlungsmöglichkeiten anbieten zu können, die zu einer Verbesserung der Lebensqualität von Epilepsiepatienten beitragen.
Antiepileptika Eslicarbazepinacetat
Eslicarbazepinacetat mit seinem primären Metaboliten Eslicarbazepin wirkt über die Inhibition spannungsgesteuerter Natriumkanäle. Das Molekül stabilisiert den Kanal in seinem langsam inaktivierten Zustand, verzögert dessen Rückkehr in den aktiven Zustand und hemmt dadurch wiederholte neuronale Entladungen.[3] Die Wirksamkeit von Eslicarbazepinacetat wurde in einer anfänglichen Proof-of-Concept-Studie der Phase II und vier aufeinander folgenden, randomisierten, placebokontrollierten Studien der Phase III mit 1703 erwachsenen unter fokalen Anfällen leidenden Patienten nachgewiesen, die refraktär gegenüber der Behandlung mit ein bis drei begleitenden Antiepileptika waren.[5],[6],[7],[8],[9]
In Europa und Russland wird Eslicarbazepinacetat derzeit von Bial sowie dem Lizenzinhaber Eisai Europe Limited, der europäischen Tochtergesellschaft von Eisai Co., Ltd., unter den Handelsnamen Zebinix® bzw. Exalief® vertrieben. In den USA und in Kanada wird Eslicarbazepinacetat von Sunovion Pharmaceuticals Inc. mit der exklusiven Lizenz von Bial unter dem Handelsnamen Aptiom® vertrieben.
Informationen zu Bial
Bial wurde 1924 gegründet. Das Leitbild des Unternehmens umfasst die Entdeckung, Entwicklung und Bereitstellung von therapeutischen Lösungen für das Gesundheitswesen. In den letzten Jahrzehnten waren die strategischen Maßnahmen von Bial vor allem auf Qualität, Innovation und Internationalisierung ausgerichtet.
Bial engagiert sich besonders im Bereich der therapeutischen Innovationen und investiert jedes Jahr ca. 20 % seines Umsatzes in die Forschung und Entwicklung (F&E).
Bial hat ein ambitioniertes F&E-Programm entwickelt, das vor allem auf die Forschung und Entwicklung im Bereich der Neurowissenschaften und des kardiovaskulären Systems abzielt. Das Unternehmen plant, in den nächsten Jahren weitere neue Arzneimittel auf den Markt zu bringen. Auf diese Weise will das Unternehmen gemäß dem Leitbild „Caring for your Health“ mit seinen innovativen Arzneimitteln die internationale Präsenz weiter stärken.
Weitere Informationen zu Bial finden Sie unter www.bial.com.
Informationen zu Eisai Co., Ltd
Eisai Co., Ltd. ist ein führendes, weltweit agierendes forschungs- und entwicklungsorientiertes Pharmaunternehmen mit Hauptsitz in Japan. Eisai hat sein Unternehmensleitbild wie folgt definiert: Im Mittelpunkt stehen die Patienten und ihre Angehörigen sowie die Verbesserung der
Gesundheitsfürsorge – wir nennen dies unsere „human health care (hhc)“-Philosophie. Mit mehr als 10.000 Mitarbeiterinnen und Mitarbeitern in unserem weltweiten Netzwerk von Forschungs- und Entwicklungseinrichtungen, Produktionsstätten und Vertriebsniederlassungen arbeiten wir an der Verwirklichung unserer hhc-Philosophie, indem wir innovative Produkte in verschiedenen therapeutischen Bereichen mit einem hohen ungedeckten medizinischen Bedarf anbieten, wie etwa der Onkologie und der Neurologie.
Als global tätiges pharmazeutisches Unternehmen engagieren wir uns gemäß unserem Unternehmensleitbild für Patienten auf der ganzen Welt – durch Investitionen und Beteiligungen an partnerschaftlichen Initiativen zur Verbesserung des Zugangs zu Arzneimitteln in Entwicklungs- und Schwellenländern.
Weitere Informationen zu Eisai Co., Ltd. finden Sie unter www.eisai.com.
Literaturhinweise
1. Zebinix® Fachinformation, Stand April 2017
2. Ben-Menachem E, et al. Efficacy of eslicarbazepine acetate versus controlled-release carbamazepine as monotherapy in patients with newly diagnosed partial-onset seizures; European Congress on Epileptology 2016: Abstract #0002
3. Hebeisen S, et al. Eslicarbazepine and the enhancement of slow inactivation of voltage-gated sodium channels: a comparison with carbamazepine, oxcarbazepine and lacosamide. Neuropharmacology 2015; 89:122-35
4. Kowacs P, et al. Safety and tolerability of eslicarbazepine acetate as monotherapy in patients with newly diagnosed partial-onset seizures. Presented at EAN 2016; abstract #P32045
5. Elger C, et al. Eslicarbazepine acetate: A double-blind, add-on, placebo-controlled exploratory trial in adult patients with partial-onset seizures. Epilepsia 2007; 48:497-504
6. Elger C, et al. Efficacy and safety of eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures: A randomised, double-blind, placebo-controlled, parallel-group phase III study. Epilepsia . 2009;50:454-63
7. Ben-Menachem E, et al. Eslicarbazepine acetate as adjunctive therapy in adult patients with partial epilepsy. Epilepsy Res . 2010;89(2-3):278-85
8. Gil-Nagel A, et al. Efficacy and safety of 800 and 1200 mg eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures. Acta Neurol Scand . 2009; 120:281-87
9. Sperling MA, et al . Eslicarbazepine acetate as adjunctive therapy in patients with uncontrolled partial-onset seizures: Results of a phase III, double-blind, randomized, placebo-controlled trial. Epilepsia. 2015 Feb;56(2):244-53. doi: 10.1111/epi.12894. Epub 2014 Dec 22.
10. Epilepsy in the WHO European Region: Fostering Epilepsy Care in Europe. Available at: http://www.ibe-epilepsy.org/downloads/EURO%20Report%20160510.pdf Accessed March 2017.
Zebinix® 200 mg/800 mg Tabletten. Wirkstoff: Eslicarbazepinacetat. Zus.: Tabletten Zebinix® 200 mg/800 mg Eslicarbazepinacetat. Zus.: Jede Tablette enthält 200 mg/800 mg Eslicarbazepinacetat. Sonst. Bestandt.: Povidon K 29/32, Croscarmellose-Natrium, Magnesiumstearat. Anw.: Monotherap. z. Behandlg. fokaler Anfälle mit/ohne sek. Generalisierg b. Erwachsenen m. neu diag. Epilepsie; Zusatztherap. b. Erwachsenen, Jugendl. und Kindern über 6 Jahren z. Behandlg. fokaler Anfälle mit/ohne sek. Generalisierg. Gegenanz.: Überempf. g. Eslicarbazepinacetat, Carboxamid-Derivate, sonst. Bestandt., AV-Block 2./3. Grades. Nebenw.: Sehr häufig: Schwindel, Schläfrigkt. Häufig: Hyponatriämie, vermind. Appetit, Schlaflosigkt., Kopfschmrz., Aufmerksamktsstrg., Tremor, Ataxie, Gleichgewichtsstrg., Diplop., verschw. Sicht, Schwindel, Übelkt., Erbrechen, Durchfall, Hautausschlg., Müdigkt., Gangstrg., Asthenie Gelegentl.: Anäm., Überempfdlkt., Hypothyr., Elektrolytunglgewt., Dehydrat., Hypochlorämie, Psychose, Apath., Depr., Nervosit., Erregg., Reizbarkt., ADHS, Verwirrtht., Stimmgsschwkg., Weinen, psy.-motor. Hemmg., Angst, abn. Koordination, Gedächtnisstrg., Amnesie, Schlafsucht, Sedierg., Aphas., Dysästhes., Dyston., Lethargie, Geruchstäuschg., zereb. Syndr., Konvulsion, periph. Neuropath., Nystagmus, Sprachstrg., Dysarthr., brenn. Gef., Parästhesien, Migräne, Sehstrg., Oszillops., binokul. Augenbewglktsstrg., okul. Hyperäm., Hörschwäche, Tinnitus, Palpitat., Bradykard., Hyper/Hypotonie (einschließl. hypert. Krise), orthos. Hypot., Flush, periph. Kältegf, Nasenbluten, Brustschmrz., Verstopfg., Dyspeps., Gastritis, Bauchschmrz., trock. Mund, Unwohls. i. Bauchber., Blähg., Zahnfleischentzdg., Teerstuhl, Zahnschmrz., Lebererkrkg., Alopez., trock. Haut, übermäßg. Schwitzen, Erythem, Hauterkrkg., Juckreiz, allerg. Dermatitis, Muskelschmrz., Knochenstoffwechselstörg., Muskelschwäche, Schmrz. i.d. Extremitäten, Harnwegsinfekt., Unwohls., Schüttelfr., periph. Ödem., Hypoton., Gewichtsverlst., Hyperton., Natrium i. Blut erniedr., erniedr. Chloridspiegel i. Blut , Osteocalcin-Anstieg, Hämatokrit/Hämoglobin erniedr., Transamin. erh., Arznmtox., Sturz, Brandwunden. Nicht bekannt: Thrombozytopen., Leukozytopen., Pankreatit., Arzneimittelexanthem m. Eosinophilie u. syst. Symptomen (DRESS). Verschreibungspflichtig. Stand: April 2017. Bial – Portela & Ca, SA, S. Mamede do Coronado, Portugal. Vertrieb in Deutschland: Eisai GmbH, Lyoner Str. 36, 60528 Frankfurt a. Main, kontakt@eisai.net .