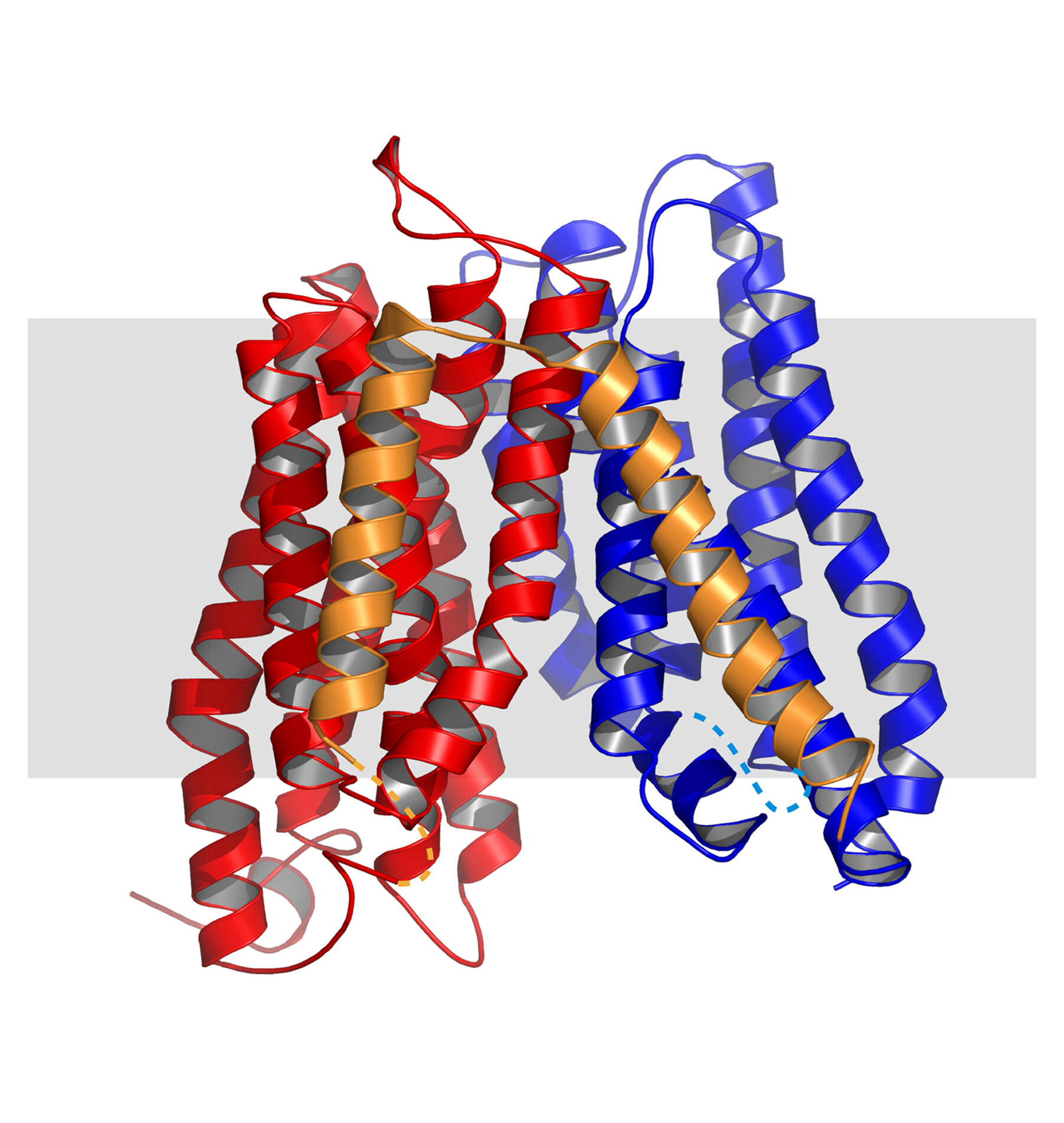
Berner Strukturbiologen ist es gelungen, die Struktur eines Membranproteins zu entschlüsseln.
Dreidimensionale (3D) Atommodelle von Proteinen sind wichtig, um deren Funktion zu verstehen. Dies ermöglicht unter anderem die Entwicklung neuer Therapieansätze für Krankheiten. Berner Strukturbiologen ist es nun gelungen, die Struktur eines wichtigen Membranproteins zu entschlüsseln – dies gelingt relativ selten und ist eine Premiere in Bern.
Membranproteine befinden sich in den Wänden der Zellen, den Zellmembranen, und nehmen im menschlichen Körper lebenswichtige Funktionen wahr. Zu ihnen gehören die Transportproteine, die als eine Art „Türsteher“ agieren, indem sie zum Beispiel Nährstoffe in die Zellen hinein- und Abfallprodukte aus den Zellen herauslassen.
Zahlreiche Transportproteine spielen bei menschlichen Krankheiten wie Krebs, Diabetes oder Depressionen Schlüsselrollen. Eine wichtige Klasse der Transportproteine bilden die Peptidtransporter der Darmzellen. Sie führen Abbauprodukte von Proteinen aus der Nahrung (Peptide) aus dem Darm durch die Zellmembranen in die Zellen hinein.
Der genaue Transportmechanismus ist aber noch weitgehend unerforscht, ebenso wie Peptide von den Transportern erkannt und „durchgeschleust“ werden. Um dies klären zu können, sind atomare Modelle – und somit die Entschlüsselung der Struktur solcher „Türsteher“ bei hoher Auflösung – von fundamentaler Bedeutung.
Strukturbiologen des Instituts für Biochemie und Molekulare Medizin der Universität Bern ist es nun gelungen, die hochaufgelöste Struktur eines Peptidtransporters zu entschlüsseln. So konnten wichtige offene Fragen zur molekularen Peptiderkennung beantwortet werden. Zudem sind die präsentierten strukturellen und funktionellen Erkenntnisse wertvoll für die Entwicklung von Arzneistoffen, zum Beispiel sogenannte „Prodrugs“, die im Darm vereinfacht aufgenommen werden. Die Studie ist im Fachjournal „BioMed Central Biology“ erschienen.
Große Herausforderung
Membranproteine sind komplexer als gewöhnliche Proteine, da sie sowohl wasser- wie auch fettliebende Bereiche besitzen. Diese chemische Eigenschaft ermöglicht ihre Verankerung in Membranen, macht sie aber biochemisch schwierig zu handhaben.
„Die Erforschung der 3D-Struktur von Membranproteinen ist extrem anspruchsvoll und stellt in der Strukturbiologie eine grosse Herausforderung dar“, sagt Dimitrios Fotiadis vom Institut für Biochemie und Molekulare Medizin der Universität Bern und vom Nationalen Forschungsschwerpunkt (NFS) „TransCure“. So wurde der Nobelpreis für Chemie 1988 Forschern für die Bestimmung der ersten hochaufgelösten Membranprotein-Struktur verliehen. Es folgten zwei weitere Nobelpreise für Chemie in den Jahren 2003 und 2012 für die Struktur und Funktion von Membranproteinen.
Das Forscherteam rund um Dimitrios Fotiadis hat die Struktur eines bakteriellen Peptidtransporters, der mit den menschlichen Transportern verwandt ist, entschlüsselt. Das Atommodell des Peptidtransporters konnte mittels Röntgenkristallographie bestimmt werden. Dafür müssen Proteine kristallisiert werden, was besonders bei Membranproteinkristallen sehr schwierig sein kann. „Wir freuen uns sehr über diesen Erfolg“, sagt Fotiadis. „Er zeigt, dass die Berner Strukturbiologie und der NFS TransCure auf internationaler Ebene beitragen, offene Fragen zu Transportproteinen zu klären und dadurch auch neue Therapieansätze für weitverbreitete Krankheiten zu ermöglichen.“