Mittels WAVE-Komplex, an den kleine regulatorische Proteine binden können, manipulieren und regulieren Bakterien das Zytoskelett.
Bakterien manipulieren ihre Wirtszellen, damit diese sie bei einer Infektion ins Zellinnere aufnehmen. Dazu benutzen sie gezielt das Proteingerüst der Zellen, um sich besser an Zellen anheften zu können. Schließlich dringen sie so auch in die Zellen ein und breiten sich aus. Eine Schlüsselrolle bei der Kontrolle dieser Umbauten im Zytoskelett spielt der WAVE-Komplex, an den kleine regulatorische Proteine, sogenannte GTPasen, binden können. Forscher des Helmholtz-Zentrums für Infektionsforschung (HZI) konnten nun den mehrstufigen molekularen Mechanismus der WAVE-Komplex-Aktivierung aufklären.
Das Zytoskelett der Zellen
Zellen besitzen ein sogenanntes Zytoskelett. Dieses Zytoskelett stellt ein Netzwerk von Filamenten dar, das nicht nur die Plasmamembran stützt und der Zelle eine Form verleiht. Denn es unterstützt auch die korrekte Position von Organellen und eröffnet Wege für den Transport von Vesikeln.
Das Zytoskelett der Zelle besteht aus kleinen Mikrofilamenten, die aus dem Protein Aktin aufgebaut und wie in einem Geflecht verwoben sind. Erst das Zusammenspiel der nur nanometerdicken verzweigten Aktin-Filamente sowie der dadurch vermittelten Kraftentwicklung ermöglichen Zellbewegungen.
Schließlich spielen diese Mechanismen eine wichtige Rolle bei zellulären Prozessen wie der Phagozytose. Diese bezeichnet die kontrollierte Aufnahme extrazellulärer, potenziell gefährlicher Partikel wie Mikroorganismen durch professionelle Fresszellen. Das Zytoskelett hat aber auch eine besondere Bedeutung bei der Infektion von Wirtszellen durch krankmachende Erreger.
Wie Bakterien das Zytoskelett für ihre Besiedelung nutzen
Bakterien können zelluläre Signalwege beeinflussen und sie so dazu nutzen, Zellen zu besiedeln oder in diese einzudringen. Erreger wie Salmonellen, Shigellen oder Yersinien injizieren zum Beispiel mithilfe molekularer Spritzen bestimmte Proteine direkt in ihre Wirtszellen, um Umstrukturierungen des Aktin-Skeletts zu stimulieren.
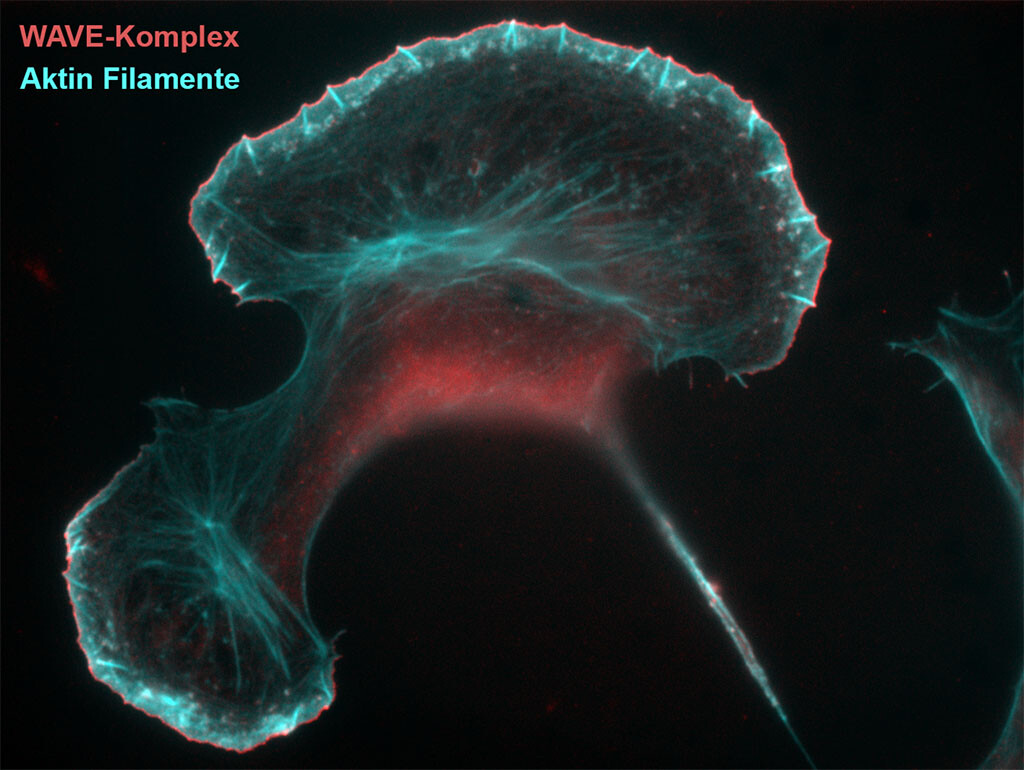
Ein Zielfaktor der Bakterien ist dabei der sogenannte WAVE-Komplex, der die Bildung der Aktin-Filamente steuert. Der Begriff kommt aus dem Englischen und heißt auch WAVE regulatory complex – abgekürzt WRC. Dieses Zusammenspiel von Bakterien mit dem Zytoskelett des Wirts bei Infektionen besser zu verstehen, hat sich das Forscherteam um Prof. Klemens Rottner, Leiter der HZI-Arbeitsgruppe „Molekulare Zellbiologie“ und einer gleichnamigen Abteilung im Zoologischen Institut der Technischen Universität Braunschweig, zur Aufgabe gemacht.
Welcher molekulare Mechanismus in Zellen den WAVE-Komplex aktiviert
Die Forscher konnten zeigen, über welchen molekularen Mechanismus in Zellen der WAVE-Komplex aktiviert wird. Dieser WAVE-Komplex spielt eine entscheidende Rolle bei der Polymerisierung des Strukturproteins Aktin. Das ausschlaggebende Signal ist dabei ein molekularer Schalter, die kleine GTPase Rac. Diese wechselt durch Bindung an das energiereiche Nukleotid GTP (Guanosintriphosphat) – nach dessen Spaltung an GDP (Guanosindiphosphat) – zwischen den Positionen ‚Ein‘ und ‚Aus‘. „Der WAVE-Komplex als eines der wichtigsten Steuerelemente wird durch Bindung des zentralen molekularen Schalters Rac an zwei unabhängigen Bindungsstellen reguliert“, sagt Klemens Rottner. Bislang waren die Funktionen dieser unabhängigen Rac-Bindestellen des aus fünf Untereinheiten bestehenden WAVE-Komplexes aber noch unklar.
Die Wissenschaftler nutzten verschiedene Zelllinien aus Mäusen, bei denen einzelne oder auch beide Bindestellen gleichzeitig mithilfe der CRISPR/Cas9-Technologie ausgeschaltet wurden. „Mit diesen mutierten Zellen konnten wir die unterschiedlichen Funktionen der beiden Bindestellen am WAVE-Komplex entschlüsseln“, sagt Matthias Schaks, Wissenschaftler im Team von Klemens Rottner. Für die strukturbiologische Analyse des Bindemechanismus kooperierten die Wissenschaftler zudem eng mit der HZI-Abteilung „Struktur und Funktion der Proteine“ um Prof. Wulf Blankenfeldt.
„Wir konnten zeigen, dass die als A-site bezeichnete erste Bindestelle die Hauptbindestelle für die sogenannte allosterische Aktivierung des WAVE-Komplexes ist. Dockt dort GTP-gebundenes Rac an, ändert das die dreidimensionale Struktur des Komplexes“, sagt Klemens Rottner. Im Gegensatz dazu sei die zweite Bindestelle, die D-Site, zwar entbehrlich für die Aktivierung des WAVE-Komplexes. Sie ist aber entscheidend für die effiziente Aufrechterhaltung seiner Aktivität und damit seiner Funktion in Zellen. Das ist die Ausbildung von Membranausstülpungen, den sogenannten Lamellipodien. Den beschriebenen, evolutionär sehr alten Mechanismus der Regulation durch beide Bindestellen konnten die Forscher jetzt sogar bei einfachen Schleimpilzen der Gattung Dictyostelium bestätigen.
Aussicht
Die für dieses Projekt entwickelten Zellsysteme, die zur Aufklärung des beschriebenen Mechanismus geführt haben, erlauben nun auch den Einsatz in Infektionsversuchen mit verschiedensten bakteriellen Erregern, die sich der Manipulation des Zellskeletts ihrer Wirtszellen bedienen. Dazu gehören beispielsweise gramnegative Salmonellen und Shigellen sowie auch grampositive Listerien und Staphylokokken. Die Wissenschaftler wollen die vielschichtigen Interaktionen mit dem Wirt und die Infektionswege in seine Zellen nicht nur besser verstehen, sondern letztendlich sogar verhindern.
Literatur: Matthias Schaks, Shashi Prakash Singh, Frieda Kage, Peter Thomason, Thomas Klünemann, Anika Steffen, Wulf Blankenfeldt, Theresia E. Stradal, Robert H. Insall, and Klemens Rottner. Distinct Interaction Sites of Rac GTPase with WAVE Regulatory Complex Have Non‐redundant Functions in Vivo, Current Biology (2018). https://doi.org/10.1016/j.cub.2018.10.002
Quelle: Helmholtz-Zentrum für Infektionsforschung (HZI) – https://www.helmholtz-hzi.de



